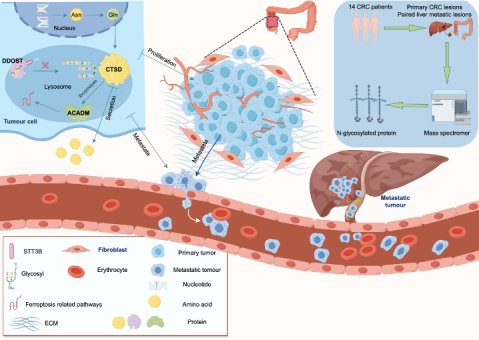
肝转移是导致结直肠癌患者预后差的主要原因。80%~90%结直肠癌肝转移患者无法获得根治性治疗,5 年生存率低,因此,迫切需要深入研究结直肠癌肝转移的新机制和开发新的治疗策略。目前研究发现,糖蛋白的N-糖基化修饰影响肿瘤转移,但N-糖基化修饰是否在结直肠癌肝转移中发挥作用尚属未知。
近日,北京大学人民医院胃肠外科申占龙教授、叶颖江教授和中国科学院生物物理研究所李岩教授合作,在国际权威期刊Advanced Science在线发表研究论文N-glycosylation modification of CTSD affects liver Metastases in colorectal cancer(CTSD的N糖基化修饰影响结直肠癌发生肝转移),有望为结直肠癌肝转移患者的靶向治疗提供新策略。
“结直肠癌是全球前五大致死性癌症之一,肝转移是其不良预后的主要因素。为了深入理解结直肠癌肝转移的分子机制,并探索潜在的治疗方法,我们对结直肠癌原发灶与肝转移灶之间的N-糖基化蛋白组进行了深入比较和分析,识别出了可能在结直肠癌肝转移中起关键作用的糖基化蛋白质——Cathepsin D(CTSD)。”申占龙教授介绍道。
N-糖基化是蛋白质的一种重要翻译后修饰方式,涉及在糖基转移酶的作用下,将糖类转移至蛋白质上特定的天冬酰胺残基,形成糖苷键。这种修饰在哺乳动物细胞中广泛存在,对蛋白质的功能、稳定性和运输等方面发挥关键作用。
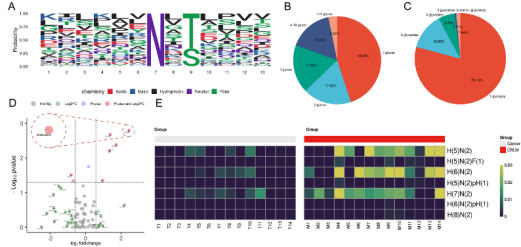
团队首先采用液相色谱-质谱联用技术,鉴定14例结直肠癌患者的肝转移灶和原发灶间的N-糖基化蛋白谱,发现了在两者之间存在显著差异的N-糖基化糖肽。更重要的是发现关键的N-糖基化蛋白CTSD的N-糖基化水平能调控结直肠癌肝转移能力。
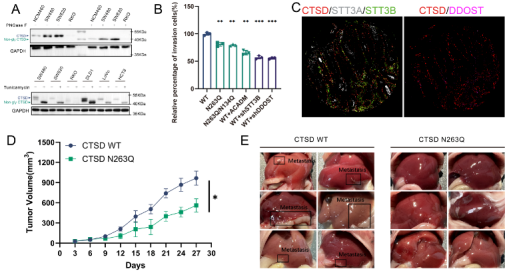
继续深挖发现N-糖基化蛋白CTSD的N-糖基化水平可以被三种方式所抑制:添加N-糖基化修饰的抑制剂Tunicamycin、PNGaseF,和突变CTSD的263位点的N-糖基化修饰显著增加,抑制CTSD的N-糖基转移酶(DDOST 和STT3B)。
通过细胞和动物模型,研究人员进一步验证了三种方法可以有效抑制糖基化蛋白CTSD的N-糖基化水平,进而抑制结直肠癌肝转移能力。此外,改变CTSD的下游调控分子ACADM的水平,也可以影响结直肠癌肝转移能力。这些发现将为结直肠癌肝转移治疗提供潜在靶点。
本研究通过深入分析结直肠癌原发灶与肝转移灶之间的N-糖基化蛋白组,发现并揭示了CTSD的N-糖基化修饰在结直肠癌肝转移中的关键作用,为深入理解结直肠癌肝转移的分子机制提供了新的见解。
本研究还鉴定出能够抑制这一过程的N-糖基化抑制剂。Tunicamycin和PNGaseF等N-糖基化抑制剂的发现,可通过抑制CTSD的N-糖基化修饰,抑制结直肠癌细胞的侵袭与转移。申占龙说,通过聚焦CTSD的263位点的N-糖基化修饰,将为基因编辑技术治疗结直肠癌肝转移提供新靶点。靶向CTSD的上下游蛋白(DDOST, STT3B和ACADM)也可能是结直肠癌肝转移治疗的新思路,未来的临床应用还需要进一步的研究和验证,希望为患者带来更好的治疗效果和预后。
北京大学人民医院胃肠外科熊楠博士、杜衍博士和中国科学院生物物理研究所黄纯翠副研究员为该论文共同第一作者。北京大学人民医院胃肠外科申占龙教授、叶颖江教授和中国科学院生物物理研究所李岩教授为该论文共同通讯作者。
(供稿:科研处 责编:钟艳宇)